Tras la cirugía refractiva, se ha documentado que los nervios corneales y las células estromales y epiteliales liberan neuromediadores o neuromoduladores que desempeñan un papel importante en los procesos de inflamación neurogénica postoperatoria, la reparación corneal y en la regeneración nerviosa. En su revisión, Yang, Mehta y Liu (2021) exploran a fondo cómo estos neuromediadores influyen en los resultados quirúrgicos.
Los nervios sensoriales, que inervan principalmente la córnea, desempeñan funciones aferentes y eferentes que posibilitan la sensación táctil y dolorosa, así como la liberación de neuromediadores. La mayoría de los nervios sensoriales de la córnea producen neuropéptidos y neurotrofinas, lo cual favorece la comunicación neuronal en esta región. Es importante señalar que la inervación autonómica de la córnea proviene de fibras simpáticas y parasimpáticas que, a pesar de ser limitada, la inervación simpática desempeña una función fundamental al liberar neurotransmisores como las catecolaminas. En contraste, los nervios parasimpáticos liberan acetilcolina.
Además de las neuronas, las células epiteliales de la córnea contribuyen en la síntesis de neuromediadores, como acetilcolina, y también producen neurotrofinas, que se originan en las células epiteliales, endoteliales y del estroma corneal. Este proceso es complejo debido a la diversidad de fuentes celulares involucradas.
Las neurotrofinas son moléculas fundamentales que controlan procesos importantes en el desarrollo y la plasticidad de las neuronas, así como en la supervivencia y la recuperación de los nervios. Por ejemplo, el factor de crecimiento nervioso (NGF, por su sigla en inglés), es uno de los factores más estudiados y tiene una función fundamental en la densidad y sensibilidad de los nervios corneales. Se ha demostrado que el NGF desempeña un papel fundamental en la preservación de la integridad de los nervios corneales tras una lesión.
Por otra parte, la cenegermina, en su forma recombinante, ha mostrado eficacia en humanos con lesiones en el epitelio corneal que no cicatrizan, como las presentes en la queratopatía neurotrófica, facilitando el proceso de curación y la regeneración nerviosa. El NGF, como se ha mencionado, tiene la capacidad de influir en diversos procesos a nivel celular., incluyendo la estimulación de la regeneración de los nervios y la modulación de células madre corneales, promoviendo tanto su diferenciación como su migración, hacia el sitio de la lesión que se debe reepitelizar.
Entretanto, el factor neurotrófico derivado de glía (GDNF, por su sigla en inglés), es una neurotrofina importante en la córnea que presenta funciones equiparables a las del NGF. El GDNF ha sido comprobado en investigaciones de laboratorio que está implicado en procesos como la migración celular, la formación de colonias y la proliferación de células epiteliales corneales. Por lo cual, es fundamental en el proceso de reparación de los tejidos corneales. El GDNF, se ha estudiado como un importante recurso terapéutico en la restauración de la función corneal y la regeneración nerviosa, posterior a procedimientos quirúrgicos.(1)
El factor neurotrófico ciliar (CNTF, por su sigla en inglés). por su parte, tiene un papel fundamental en la activación de las células progenitoras epiteliales corneales. Además, se ha sugerido que el CNTF es un agente promotor de la cicatrización de heridas y la regeneración nerviosa en modelos experimentales murinos con lesiones en el epitelio corneal. Lo anterior sugiere también la viabilidad de utilizar el CNTF en terapias destinadas a acelerar la recuperación de la córnea.
La neurotrofina-3 (NT-3, por su sigla en inglés), es un factor crucial para la supervivencia de los nervios sensoriales y simpáticos en la córnea, además de desempeñar un papel en la modulación de la ramificación neuronal. Este compuesto es clave para proteger los nervios y promover la formación de nuevas conexiones neuronales, fundamental para la restauración de la función sensorial y autonómica de la córnea luego de una lesión.
En cuanto a los neuropéptidos, estos actúan como mensajeros vitales en la regulación del homeostasis y la facilitación de los procesos de curación. Dentro de los neuropéptidos más relevantes se destacan la sustancia P (SP) y el péptido relacionado con el gen de la calcitonina (CGRP, por su sigla en inglés). La SP, al igual que el NGF, ejerce un efecto trófico en el epitelio corneal al modular la proliferación, migración y adhesión celular. También es relevante el factor de crecimiento epidérmico (EGF, por su sigla en inglés), que protege la barrera epitelial corneal y la inhibición de la apoptosis, aspectos fundamentales para la regeneración de la córnea después de una lesión.
También se debe mencionar al péptido relacionado con el gen de la calcitonina (CGRP, por su sigla en inglés), que se produce en mayor cantidad tras una lesión en la córnea, lo que estimula la circulación sanguínea en el ojo y favorece la regeneración del epitelio. El CGRP también tiene un papel en la regulación de la inmunidad innata al permitir la migración de neutrófilos hacia zonas inflamadas. Esta función resulta crucial en la respuesta ante lesiones corneales. Se ha observado que niveles bajos de CGRP se asocian con la severidad de la sequedad ocular, lo que indica su potencial como biomarcador en el estudio del ojo seco.
Otro neuropéptido para destacar en la córnea es el péptido intestinal vasoactivo (VIP, por su sigla en inglés), el cual se encuentra expresado en menor proporción en los nervios corneales. Este neuropéptido juega un papel fundamental en los procesos de cicatrización de heridas y regeneración nerviosa en el epitelio corneal. Se ha comprobado que el VIP posee propiedades antiinflamatorias y favorece la viabilidad de las células endoteliales corneales ante situaciones de estrés oxidativo. Su habilidad para regular la respuesta inflamatoria y estimular la generación de factores neurotróficos lo convierte en un regulador de la curación corneal, especialmente en casos como la córnea diabética. Ver Figura 1.
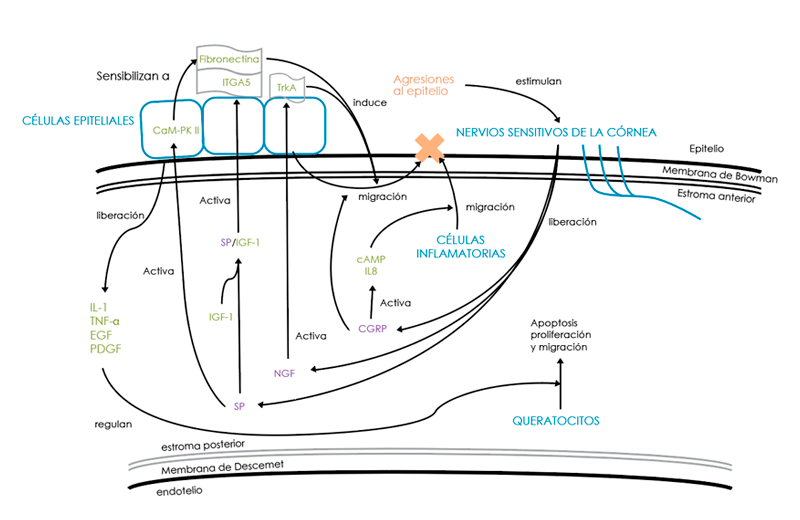
Figura 1. Esquema que ilustra el proceso de inflamación neurogénica tras una lesión en la córnea, como es el caso de la cirugía refractiva. El daño a los nervios corneales desencadena cascadas inflamatorias, neuroinflamatorias y de cicatrización en la córnea. cAMP: Adenosina monofosfato cíclico; CaM-PK II: Quinasa dependiente de calmodulina II; CGRP: Péptido relacionado con el gen de la calcitonina; EGF: Factor de crecimiento epidérmico; IGF-1: Factor de crecimiento similar a la insulina-1; IL: Interleucina; ITGA: Integrina alfa; NGF: Factor de crecimiento nervioso; PDGF: Factor de crecimiento derivado de plaquetas; SP: Sustancia P; TNF-α: Factor de necrosis tumoral-α; TrkA: Quinasa de receptor de tropomiosina A. Tomado de Yang, Mehta y Liu (2021)1
En cuanto al comportamiento de los neuromediadores en la cirugía refractiva, especialmente con láser, se ha establecido que estos procedimientos desencadenan una serie de transformaciones complejas, las cuales son cruciales en la cicatrización y la homeostasis después de la operación. Tras la ablación o la incisión quirúrgica, se produce la activación de los nervios sensoriales corneales, lo cual conlleva a la liberación de neuropéptidos como SP y CGRP, los cuales promueven el proceso de inflamación neurogénica como respuesta a la cirugía refractiva.
También se afirma que el CGRP es otro mediador fundamental que interviene en la respuesta inmune innata. En el caso de la cirugía refractiva, este promueve la migración de células inflamatorias, como los neutrófilos, hacia la zona de la herida al activar el AMPc (AMP cíclico) y la interleuquina-8 (IL-8). Ambos neuropéptidos participan en la regulación de la respuesta inflamatoria y en el estímulo del proceso de regeneración de la córnea, aspectos fundamentales para la calidad de la visión y la estabilidad refractiva después de la cirugía.
Diversos estudios han investigado los efectos de la cirugía refractiva con láser, como LASIK, PRK, FLEx y SMILE, en los neuromediadores, resaltando cómo estos procedimientos impactan en la curación de la córnea y la sensibilidad corneal postoperatoria. Desde los inicios se ha observado un notable aumento en los niveles de CGRP durante los dos primeros días después de la operación, seguido de una disminución hacia el séptimo día. La liberación inicial de CGRP se atribuyó entonces a la secreción de los nervios estromales dañados durante la cirugía. A pesar de la hipersecreción de lágrimas postoperatorias, las concentraciones de CGRP en las lágrimas no mostraron una disminución significativa. Esto sugiere que los nervios sensoriales corneales podrían estar produciendo CGRP de manera simultánea, lo que favorece la respuesta inflamatoria local y la posterior curación.
Los estudios han demostrado, por ejemplo, que la relación entre el NGF y la proteína total en las lágrimas (NGF/tP) experimenta un aumento significativo después de la PRK en el periodo postoperatorio inmediato. Este aumento alcanzó su punto máximo en el primer día, para luego disminuir gradualmente hasta el sexto mes. Por el contrario, durante el primer mes, se observó que la relación NGF/tP en el procedimiento LASIK fue inferior a la del PRK. Sin embargo, tras este periodo inicial, no se identificaron diferencias significativas entre estos dos procedimientos. Las variaciones en los niveles de NGF en las lágrimas después de la cirugía sugieren una posible relación entre las respuestas inflamatorias y tróficas inducidas por los procedimientos de PRK y LASIK, y las diferencias en la curación de las heridas corneales en cada uno.
Por otra parte, el procedimiento SMILE muestra un perfil neuromodulador diferente en comparación con el LASIK. Se ha observado que las concentraciones de NGF y de interleuquina-6 (IL-6) experimentan un incremento en el contenido lagrimal posterior a ambos procedimientos. No obstante, en la técnica SMILE, los niveles retornan a valores normales de manera más acelerada, aproximadamente tres meses después de la intervención quirúrgica.
La diferencia en la recuperación neuromoduladora entre estas técnicas se debe a las particularidades inherentes de cada una de ellas. En LASIK, se realizan cortes y resecciones en las fibras nerviosas estromales, lo que resulta en una amplificación de la respuesta inflamatoria y, en consecuencia, en una mayor liberación de NGF. Por el contrario, SMILE interrumpe exclusivamente los nervios adyacentes a la incisión y a la lentícula refractiva, lo que favorece la preservación óptima de los nervios periféricos y una pronta recuperación de la sensibilidad corneal.
En conclusión, Yang, Mehta y Liu (2021) describen que el comportamiento en estos mediadores después de la cirugía refractiva está fuertemente relacionadas con las técnicas quirúrgicas empleadas y el nivel de lesión en el tejido corneal. Los avances en la evaluación de los nervios corneales y la comprensión cada vez mayor del papel de los neuromediadores han generado nuevas posibilidades para empleados como biomarcadores en la evaluación de la superficie ocular y la condición de los nervios tras someterse a cirugía refractiva. De esto dependerá el direccionamiento en enfermedades de superficie ocular derivadas de la cirugía refractiva, como el ojo seco.
Adaptado de:
- Yang L, Mehta J, Liu YC. Corneal neuromediator profiles following laser refractive surgery. Vol. 16, Neural Regeneration Research. Wolters Kluwer Medknow Publications; 2021. p. 2177–83.