Los azúcares, ácidos grasos, y aminoácidos, se derivan de la ingesta de carbohidratos, grasas y proteínas; y son, por lo tanto, los tres insumos principales que el organismo requiere para mantener el equilibrio energético. Pero estos insumos no solamente se requieren para generar energía, también son utilizados como bloques de construcción para la síntesis de otras moléculas importantes como los lípidos. Es así como la betaoxidación mitocondrial de los ácidos grasos (mFAO) es la vía principal para la degradación de estos. El sistema mFAO genera energía en el estado post absorción, así como en el ayuno cuando el suministro de glucosa es limitado. Los productos finales de la mFAO como la acetil-coenzima-A (acetil-CoA), se transforman en cuerpos cetónicos, y 3-hidroxibutirato por el hígado, que posteriormente se pueden utilizar por casi todos los órganos en ayunos prolongados, como fuente de energía. De esta manera se destaca, que incluso en adecuada disponibilidad de glucosa, la vía de la mFAO es el principal suministro energético para el corazón, el músculo esquelético, y los riñones.1
La proteína trifuncional (TFP), es un complejo proteico que cataliza tres actividades enzimáticas específicas en el sistema mFAO: 2-3 enoil CoA hidratasa, 3-hidroxiacil-CoA deshidrogenasa de cadena larga (LCHAD), y 3-cetoacil-CoA tiolasa.2
Los trastornos de la proteína trifuncional mitocondrial son condiciones raras, autosómicas recesivas, que alteran el metabolismo de los ácidos grasos. Los pacientes que sufren estas afecciones sufren de manifestaciones tempranas como episodios de hipoglucemia hipocetósica, miocardiopatía, rabdomiólisis, hepatomegalia, y muerte súbita.2,3
La deficiencia de LCHAD (LCHADD, OMIM # 609016), se caracteriza por la mutación común c.1582G>C en al menos un alelo del gen HADHA, que produce una expresión proteica normal para el complejo enzimático, y una deficiencia marcada de LCHAD con relativa afección de las otras 2 actividades enzimáticas.2
El ayuno, infecciones y estrés pueden causar hipoglucemia hipocetósica en pacientes con LCHADD. Por lo tanto, la enfermedad es tratada mediante una dieta baja en grasas, complementada con aproximadamente el 20% de calorías cuyo origen son suplementos de triglicéridos de cadena media y suplementos vitamínicos, ácidos grasos esenciales y minerales. Los niños con LCHADD son intolerantes al ayuno, lo que conlleva a que la ingesta de nutrientes nocturna sea necesaria la mayoría de las veces. En algunos casos, el tratamiento con polímeros de glucosa o infusión de glucosa son una opción de emergencia en infecciones con cuadros febriles y gastroenteritis.4
El diagnóstico clínico de la LCHADD no es sencillo. Además de los signos anteriormente mencionados, se requiere la medición de las actividades enzimáticas de la TFP en fibroblastos o la presencia de acilcarnitina en sangre. Adicional claro está al estudio de la mutación genética. Sin embargo, aún no se han identificado biomarcadores específicos para detección de esta patología.5
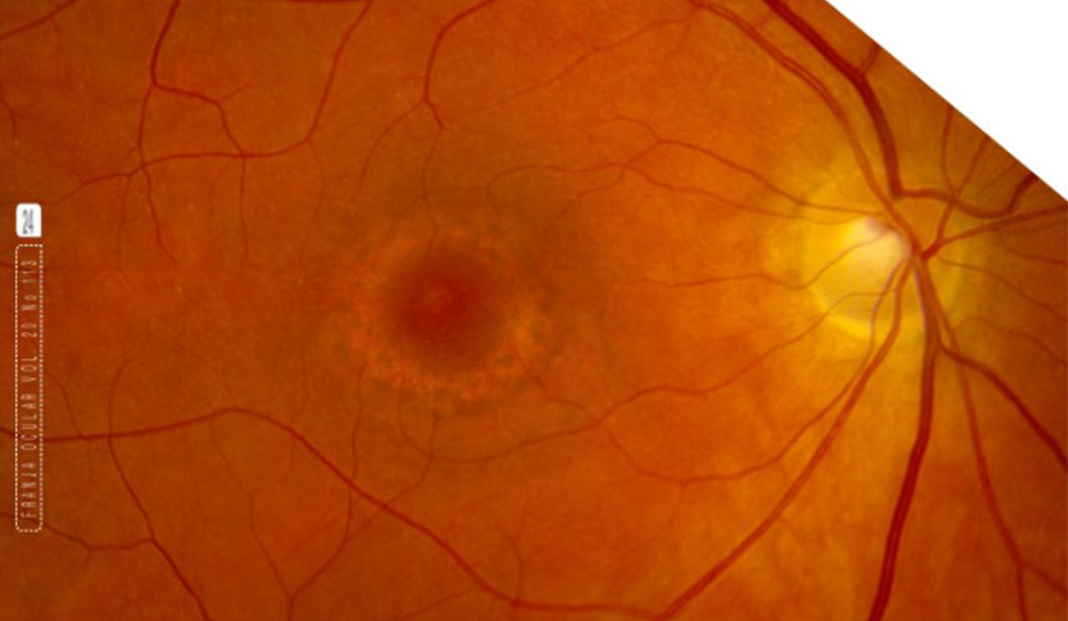
Las manifestaciones oculares se presentan a largo plazo; acompañados de deficiencia cognitiva y neuropatía periférica. Los primeros signos, suelen ser vistos como pigmentaciones retinianas, que progresan a estafilomas posteriores, aparición de miopía, función retiniana alterada a través de la disfunción de fotorreceptores que se manifiestan en un electrorretinograma (ERG) alterado. Las manifestaciones en retina suelen clasificarse en 4 etapas: 1. Fondo de ojo normal o pálido con visión y ERG normales. 2. Aglutinación del epitelio pigmentario de la retina (EPR) y deterioro del ERG. 3. Progresión y atrofia coriorretiniana y 4. Estafiloma posterior y ERG extinguido.4 Se asume que estos cambios se originan porque los procesos de beta oxidación es un proceso activo en la retina por la demanda alta de energía que requiere su metabolismo; por otro lado, la coroidopatía podría explicarse gracias que la posible acumulación de los ácidos grasos no metabolizados causa efectos tóxicos en el tejido.4 Ver Figuras 1 y 2
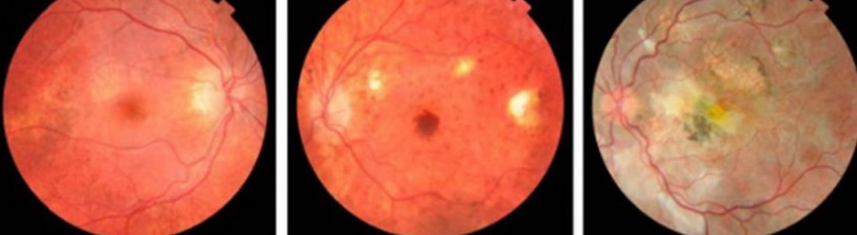
PIE DE FOTO: Figura 1. Se observa la atrofia progresiva del EPR, cambios pigmentarios y fibrosis sub-retiniana. La mácula también se va hiperpigmentando.4
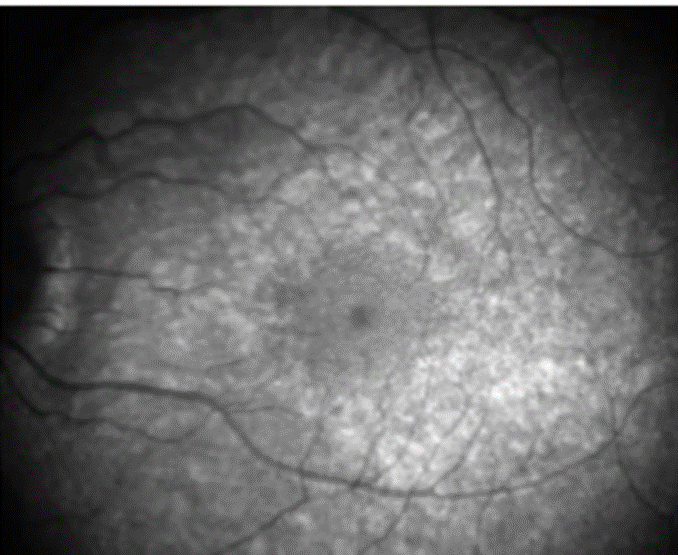
PIE DE FOTO: Figura 2. La autofluorescencia con luz infrarroja muestra acumulación de melanina en la mácula.
También es importante resaltar que se han encontrado niveles de ácido docosahexanoico (DHA) muy bajos en la retina, y sabiendo que es un componente abundante en la membrana de los fotorreceptores, se presume que es una causa importante del deterioro visual, la retinopatía y la alteración evidente del ERG.3
Boese et al 2016, documentó que, a pesar de la detección y tratamiento temprano de la enfermedad, los cambios retinianos y coroideos eran progresivos en gran proporción de los 21 casos que formaron parte de su estudio.2
Androudi et al 2018, reportó un caso severo de LCHADD en un joven de 17 años que mostraba una retina distrófica, con áreas de atrofia coroidea peripapilar y un anillo marcado de pigmento aglutinado en la media periferia de la retina, con presentación bilateral.6 Ver Figura 3
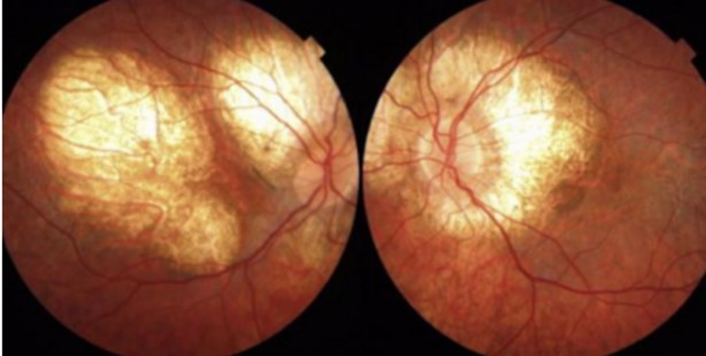
PIE DE FOTO: Figura 3. Retina distrófica, con áreas de atrofia coroidea peripapilar y un anillo marcado de pigmento aglutinado en la media periferia de la retina.
Fahnehjelm et al 2016, al explorar las alteraciones oculares por LCHADD, manifiesta que que pueden ser aminoradas por la adherencia estricta al tratamiento dietario, y que el control oftalmológico debe ser anual con el respectivo análisis del ERG en la medida de lo posible, siendo indispensable en la etapa diagnóstica.4
CONCLUSIÓN
Las enfermedades metabólicas pueden ser mortales y la LCHADD no es la excepción; por esta razón, en infantes que presenten hipoglucemias, retrasos cognitivos y de crecimiento, se debe explorar la posible presencia de LCHADD y seguir los signos oftalmológicos y el control del tratamiento del paciente para evitar deterioro marcado de la función corporal, y discapacidad visual severa.
REFERENCIAS
- Wanders RJA, Visser G, Ferdinandusse S, Vaz FM, Houtkooper RH. Mitochondrial Fatty Acid Oxidation Disorders: Laboratory Diagnosis, Pathogenesis, and the Complicated Route to Treatment. J Lipid Atheroscler. 2020;9(3):313.
- Erin A. Boese, Nieraj Jain, Yali Jia, Catie L. Schlechter, Cary O. Harding, Simon S. Gao, et al. Characterization of chorioretinopathy associated with mitochondrial trifunctional protein disorders: Long-term follow- up of 21 cases. HHS Public Access. 2016;176(1):1–23.
- Llorca-Cardeñosa A, Català-Mora J, García-Cazorla A, Meavilla S, Castejón-Ponce E. Déficit de 3-hidroxiacil-CoA-deshidrogenasa de cadena larga: a propósito de un caso. Arch Soc Esp Oftalmol. 2016;91(5):236–9.
- Fahnehjelm KT, Liu Y, Olsson D, Amrén U, Haglind CB, Holmström G, et al. Most patients with long-chain 3-hydroxyacyl-CoA dehydrogenase deficiency develop pathological or subnormal retinal function. Acta Paediatr Int J Paediatr. 2016;105(12):1451–60.
- Immonen T, Turanlahti M, Paganus A, Keskinen P, Tyni T, Lapatto R. Earlier diagnosis and strict diets improve the survival rate and clinical course of long-chain 3-hydroxyacyl-CoA dehydrogenase deficiency. Acta Paediatr Int J Paediatr. 2016;105(5):549–54.
6. Androudi S, Mataftsi A, Brazitikos P. Retinal Dystrophy in LongChain 3-hydroxyacyl-CoA Dehydrogenase Deficiency. Ophthalmol Retin. 2018;2(1):74.