El edema macular cistoide (EMC) se define como el aumento de espesor retiniano, especialmente en el área macular, cuya conformación morfológica corresponde a un quiste con líquido atrapado entre las capas plexiforme externa y nuclear interna de la retina. El proceso mediante el cual se forma el quiste, se supone que tiene que ver escape de fluido inflamatorio que proviene de los capilares perifoveales. Esta complicación tiene múltiples causas entre ellas la cirugía de catarata. También se ha reconocido que cuando el EMC se asocia directamente con pseudofaquia, recibe el nombre de síndrome de Irvinne Gass.1,2,3
En cuanto a la frecuencia de esta complicación, Kato et al, informan que la incidencia de EMC postoperatorio oscila entre 0.2 % a 20 %, pero gracias al desarrollo de procedimientos quirúrgicos más avanzados este valor puede reducirse de un 2.35 % a 1.17 %. Sin embargo, también los estudios han reportado que el riesgo del EMC postquirúrgico de catarata puede aumentar en pacientes con preexistencia como retinopatía diabética, membrana epirretiniana y oclusión de la vena retiniana. En concordancia con esto, Holló et al., 2020, suman otra serie de riesgos que no deben pasar desapercibidos tales como: uveítis, DMRE neovascular, retinitis pigmentosa, tracción vítrea y pacientes que han sido tratados con paclitaxel o docetaxel. También se han informado riesgos intraoperatorios propios de la extracción de la catarata como son: complicación intraoperatoria en términos de ruptura de cápsula posterior o pérdida de vítreo, PIO elevada no tratada y uso tanto preoperatorio como postoperatorio de análogos de prostaglandinas.1,4
La cuestión puede ser muy delicada, porque alrededor de la cirugía se liberan mediadores inflamatorios que promueven el aumento de la permeabilidad vascular. Como protagonistas de ellos están las prostaglandinas endógenas, algunas proteínas del complemento, factores activadores de plaquetas, citoquinas, óxido nítrico, ácido araquidónico, lisozima, factor de crecimiento vascular endotelial (VEGF) y factor de crecimiento derivado de insulina, entre otros. Se ha sugerido que todos estos mediadores se acumulan cuando existe la disrupción de la barrera hematoacuosa. De tal manera que, los factores de riesgo anteriormente mencionados y las condiciones propias de la cirugía como el trauma térmico generado por las ondas ultrasónicas y la manipulación propia del tejido ocular desencadenarían los eventos inflamatorios que llevan a la formación quística.5,3
DIAGNÓSTICO
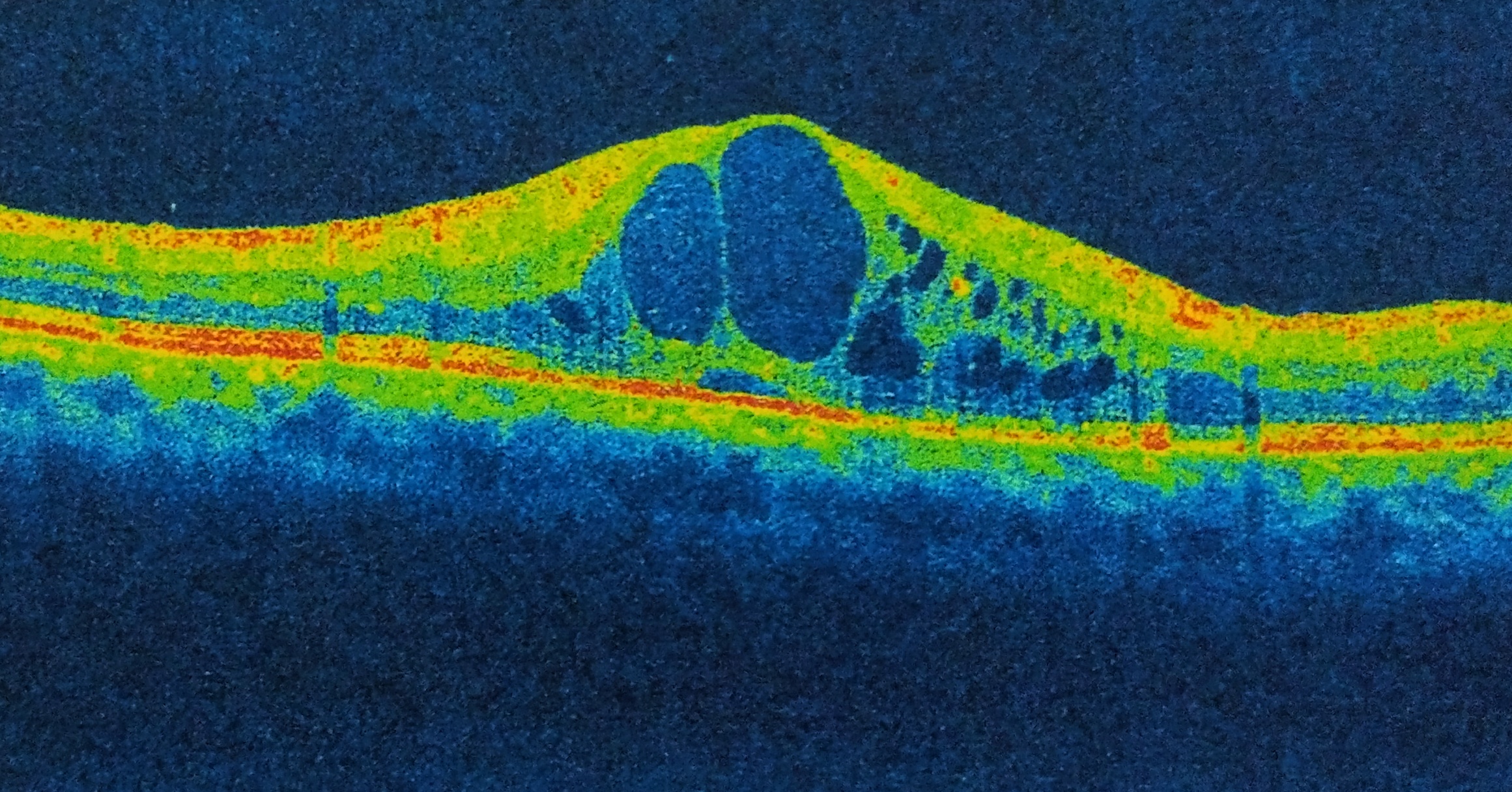
Se deben tener en cuenta la valoración biomicroscópica y la oftalmoscopía directa e indirecta, donde se podrán apreciar cambios en el fondo de ojo como hemorragias, exudados y microaneurismas. Sin embargo, esta evaluación no es concluyente ni evidente. Adicional a lo anterior, la correlación de datos con la agudeza visual disminuida que no mejora con la refracción postquirúrgica. Lo importante en este caso, es destacar que el mejor diagnóstico está dado a través de la angiografía fluoresceínica (AF) y el OCT; por ejemplo, la AF mostrará una fuga vascular perifoveal con una apariencia característica de pétalos, que puede o no estar acompañada de fugas en el disco óptico. Cabe destacar que el área de fuga de los capilares maculares mostrará la acumulación de fluido en las cavidades quísticas. Ahora bien, otra técnica diagnóstica que puede aportar información relevante es la autofluorescencia del fondo de ojo (AFF), que permitirá observar el desplazamiento del pigmento macular por los quistes y el patrón de la AFF será correlacionado con el de los pétalos de flor antes mencionados en la AF. En terrenos más específicos, se ha descrito que la prueba diagnóstica más importante, que se ha catalogado como el Gold standard para identificar el EMC, es el OCT, que mostrará de manera directa, las pequeñas cavidades quísticas hiporreflectivas redondas u ovales con unos límites de separación hiperreflectivos como tabiques entre las capas de la retina y delimitan los quistes. La ventaja más importante del OCT es que permite cuantificar a través de medidas micrométricas el área de inflamación, el tamaño de los quistes, el espesor retinal en la zona afectada, la localización exacta de los microquistes, etc.1
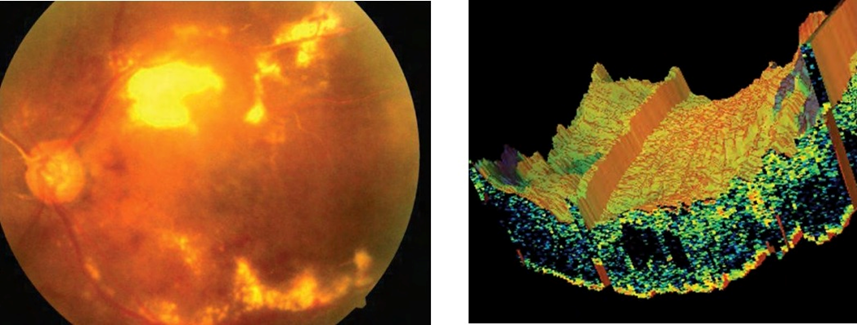
Figura 1. Edema macular. Fotos cortesía Dr. Samuel Gómez, retinólogo
MANEJO
En cuanto a las estrategias de manejo se ha establecido el uso de AINES como primera medida, teniendo en cuenta que en casos leves de EMC este resolverá espontáneamente. Otros estudios han reportado que el uso combinado de AINES y corticosteroides, e incluso con inhibidores de la anhidrasa carbónica, se destinará para los casos moderados a severos. En otras investigaciones se ha propuesto el uso de inyecciones perioculares o intravítreas de corticoides y/o anti VEGF para casos refractarios que duran más de tres meses. Ahora están emergiendo alternativas en proceso de perfeccionamiento para el EMC como el láser micropulsado o subumbral, que tiene esperanzas prometedoras.1
Lo anterior indica que, en el control posquirúrgico de catarata, se debe ser meticuloso, para no pasar por alto un EMC o síndrome de Irvine Gass, que puede ser potencialmente amenazador para la visión del paciente intervenido de catarata.
REFERENCIAS
- Holló G, Aung T, Cantor LB, Aihara M. Cystoid macular edema related to cataract surgery and topical prostaglandin analogs: Mechanism, diagnosis, and management. Surv Ophthalmol [Internet]. 2020; Available from: https://doi.org/10.1016/j.survophthal.2020.02.004
- Ilveskoski L, Taipale C, Holmström EJ, Tuuminen R. Macular edema after cataract surgery in eyes with and without pseudoexfoliation syndrome. Eur J Ophthalmol. 2019;29(5):504–9.
- Orski M, Gawęcki M. Current management options in irvine–gass syndrome: A systemized review. J Clin Med. 2021;10(19).
- Kato K, Miyake K, Hirano K, Kondo M. Management of Postoperative Inflammation and Dry Eye after Cataract Surgery. Cornea. 2019;38(11):S25–33.
5. Van Nuffel S, Claeys MF, Claeys MH. Cystoid macular edema following cataract surgery with low-energy femtosecond laser versus conventional phacoemulsification. Clin Ophthalmol. 2020;14:2873–8.