En el documento “Preferred Practice Pattern” de la AAO (Academia Americana de Oftalmología), se describe que el desprendimiento de vítreo posterior (DVP) suele manifestarse entre los 45 y 65 años en la población general, con mayor predominio de signos tempranos en el sexo masculino; aunque la mayor frecuencia corresponda al sexo femenino. No obstante, el DVP puede ocurrir de manera más temprana debido a traumas, miopía o procedimientos quirúrgicos oftalmológicos. Otros factores de riesgo descritos incluyen la menopausia, exceso de vitamina B6, inflamación intraocular y la cirugía láser previa de retina. El DVP conduce a una tracción a nivel de la base del vítreo y en áreas de degeneración tipo lattice; por lo tanto, se cree que es responsable de la mayoría de las rupturas retinianas secundarias sintomáticas que, en última instancia, pueden desembocar en un desprendimiento de retina.1,2
En el cuadro semiológico del DVP, se observa la presencia de fotopsias y miodesopsias, las cuales, al ser más pronunciados y evidentes, conllevan un mayor riesgo de desprendimiento de retina. Para su diagnóstico, se han identificado cuatro etapas a saber: 1. Separación del vítreo perifoveal con adhesión vítrea en la fóvea. 2. Completa separación del vítreo de la mácula. 3. Separación vítrea extensa con adhesión al disco, y 4. Desprendimiento de vítreo posterior completo. Adicionalmente, se afirma que los destellos se hacen más notorios en la oscuridad en aquellos pacientes que los experimentan. De tal manera, a medida que el vítreo se separa de la retina posterior hacia la base del vítreo, la tracción se manifestará a través de la intensidad de las fotopsias.1
En cuanto a las miodesopsias, estas pueden deberse a ciertas causas como el sangrado de un vaso retiniano desgarrado o avulsionado, condensaciones del colágeno vítreo o el tejido glial epipapilar (anillo de Weiss), que se desprende de la cabeza del nervio óptico y del área adyacente a la misma. Se ha estimado que hasta en un 22% de los pacientes con síntomas agudos de DVP tienen una ruptura retiniana en el momento de la primera consulta. Además, se conoce que existe una correlación directa entre la cantidad de hemorragia vítrea y la probabilidad de una rotura. Los pacientes con una DVP aguda que no manifiestan rupturas inicialmente, es probable que las desarrollen en las semanas siguientes con una alta probabilidad.1
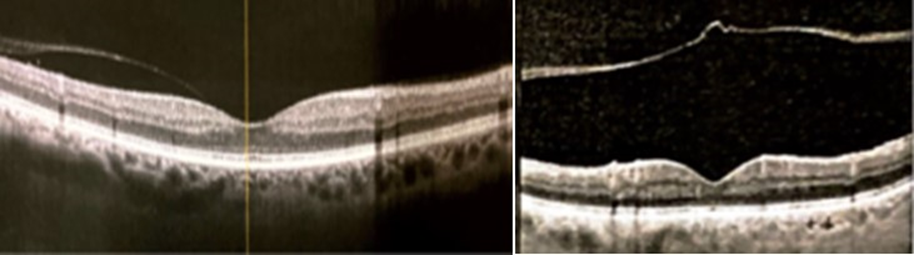
Figura 1. A la izquierda, se observa DVP perifoveal. A la derecha, un DVP total.4
Driban & Chhablani (2022) proponen otros factores de riesgo que podrían contribuir a una exploración más completa de la fisiopatogenia del DVP. Entre estos factores se encuentran el aumento en la exposición solar, la actividad física en climas más cálidos y la deshidratación. Además, resaltan la importancia de identificar oportunamente complicaciones periféricas tales como: desprendimiento de retina (DR), desgarros retinianos, agujeros maculares y la formación de membranas epirretinianas. Dado que el DR es particularmente grave, los factores de riesgo para su desarrollo incluyen hemorragia, presencia de células epiteliales pigmentadas de retina, miopía, traumatismo, pseudofaquia, afaquia, degeneración lattice, DR en el otro ojo y antecedentes familiares de DR. Todas las alteraciones anteriores coexistirán con DVP.2
En relación con la progresión del DVP en función del tiempo, Koller et al. (2022) realizan un estudio retrospectivo con el fin de identificar el área de DVP, así como el área de adhesión vitreomacular (VMAA, por su sigla en inglés), mediante exámenes con OCT. Para establecer un modelo de cambios de DVP, se utilizó el método de estimación de Turnbull. Entre los resultados más relevantes, la modelización de datos longitudinales predice que, a los 30 años, el tiempo para pasar a la etapa 4 es de 26 años; a los 40 años, es de 16 años; a los 50 años, es de 9 años; y a los 60 años, es de 8 años. De esta manera, se evidencia que las personas varían en la edad en la que progresan hacia el DVP completo. En el caso de DVP parcial temprano, el VMAA disminuye a una tasa similar entre los individuos.3
En resumen, el DVP ocurre cuando hay una separación repentina del vítreo de la membrana limitante interna de la retina (MLI), como resultado de la licuefacción dentro del cuerpo vítreo. Ahora bien, para que esto suceda, deben ocurrir dos eventos diferentes: la licuefacción del cuerpo vítreo (sinquisis) y el debilitamiento de la adhesión entre la corteza vítreo posterior y la MLI. En este sentido, el vítreo licuefactado tiende a desplazarse hacia el espacio retrocortical prepapilar y premacular, lo que ocasiona el colapso del cuerpo vítreo (sinéresis) de manera anterior.4
Como herramienta de apoyo diagnóstico, la Tomografía de Coherencia Óptica (OCT) puede mostrar con precisión la separación entre la cara posterior del vítreo y la retina, identificando un DVP superficial de manera más efectiva que la biomicroscopía con la lámpara de hendidura e incluso el ultrasonido B-scan. No obstante, cuando los cuerpos flotantes se vuelven densos y numerosos, la agudeza visual (AV) se puede afectar significativamente. En este caso, la vitrectomía se presenta como el tratamiento quirúrgico de preferencia para este tipo de pacientes. En otros escenarios, el tratamiento se han considerado opciones como el tratamiento con láser Neodimio o YAG y fotoablación. Para complicaciones más severas, se debe seguir el tratamiento recomendado en los protocolos para el DR.4
REFERENCIAS
- Flaxel CJ, Adelman RA, Bailey ST, Fawzi A, Lim JI, Vemulakonda GA, et al. Posterior Vitreous Detachment, Retinal Breaks, and Lattice Degeneration Preferred Practice Pattern®. Ophthalmology. 2020 Jan 1;127(1):P223–58.
- Driban M, Chhablani J. Clinical findings in acute posterior vitreous detachment. Graefe’s Archive for Clinical and Experimental Ophthalmology. 2022 Nov 1;260(11):3465–9.
- Koller EC, Kraker JA, Hwang ES. PROGRESSION OF PARTIAL POSTERIOR VITREOUS DETACHMENT OVER TIME. Retina. 2021 Jul 1;41(7):1396–402.
- Ramovecchi P, Salati C, Zeppieri M. Spontaneous posterior vitreous detachment: A glance at the current literature. Vol. 11, World Journal of Experimental Medicine. Baishideng Publishing Group Co; 2021. p. 30–6.