Muchos son los criterios utilizados en investigación, para definir la eficacia de una vacuna dependiendo del tipo de patógeno, las consecuencias en el cuerpo dadas por su infección, y la dinámica de transmisión de este. En el caso del virus SARS-CoV-2, la vacuna ideal, debe ser capaz de prevenir la infección, el desarrollo de la enfermedad, y la transmisión. Esto supone un reto muy importante porque el SARS-CoV-2 tiene grados de infección heterogéneos en cada individuo, que dependen de múltiples variables, tales como: edad, sexo, raza, comorbilidades, etc. Viendo esto, las consecuencias de la infección en una persona, puede ir desde paucisintomático, hasta ser atendido en unidades de cuidados intensivos, y en el peor de los casos, la muerte. (1)(2)(3) Ver Figura 1.
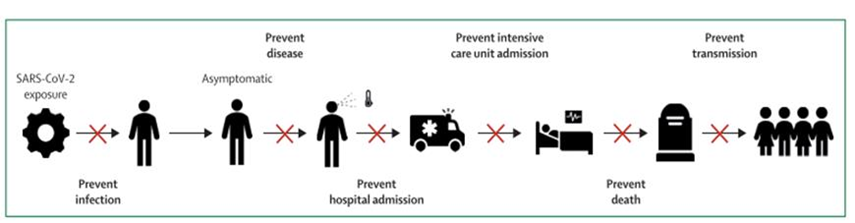
Figura 1. Objetivos para el desarrollo de una vacuna contra SARS-CoV-2: prevención de la infección, prevención de la enfermedad, prevención de la hospitalización, prevención en el ingreso a UCI, prevención de muerte, y prevención de la transmisión. (1)
Clasificación de vacunas contra el SARSCOV-2
Se han identificado diferentes plataformas para el desarrollo de vacunas contra el virus causante de la COVID-19. A continuación se presentarán las que más objeto de estudio u ensayos clínicos han tenido. Ver Figura 2.
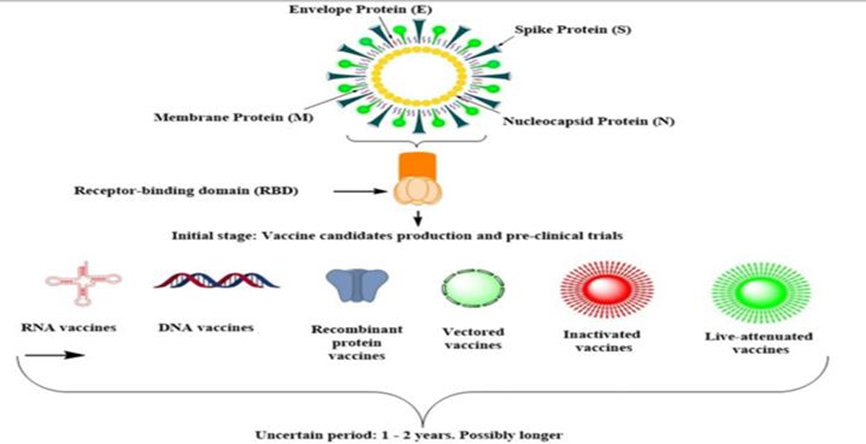
Figura 2. Diferentes plataformas y estrategias para la creación de vacunas contra el SARS-CoV-2. Es importante aclarar que la mayoría de ellas tiene como blanco la proteína spike (S). (3)
Vacunas de ARNm y ADN
En tiempos de pandemia, las vacunas de ARNm (ARN mensajero) y ADN, son las primeras candidatas susceptibles de desarrollo, ya que se pueden generar en el corto plazo, y los requisitos de bioseguridad son de un nivel accesible para los laboratorios de investigación. En las vacunas de ARNm, éste se libera dentro de la célula humana, para que se lleve un proceso de transcripción para proteínas virales; posteriormente, el sistema inmune genera anticuerpos contra estas proteínas, de tal manera, que si la persona se infecta con SARS-CoV-2, el cuerpo ya tiene reconocidos los anticuerpos contra la proteína específica del virus, proporcionando una defensa eficiente. (2)(4)
Para proporcionar una vacuna de ARNm óptima, se necesitan dos factores principales: el primero, es elegir un lípido catiónico o ionizante apropiado. Una vez este lípido ingresa a la célula, el ambiente ácido dentro de los endosomas, convierte la carga superficial en positiva, facilitando el escape endosómico y la liberación del ARNm en el citosol, para que pueda ser transcrito en el ribosoma. El segundo factor es la optimización del colesterol, los fosfolípidos auxiliares, y la composición de lípidos PEG, junto con su correspondiente proporción en la nanopartícula lipídica. (5)
Pfizer y BioNTech desarrollaron una vacuna de ARNm, denominada BNT162b1, consistente en una preparación de nanopartículas liposolubles, compuesta de ARNm, que codifica el trímero RBD de la proteína S o spike. Los ensayos clínicos con humanos demostraron desarrollar anticuerpos robustos específicos contra la proteína S, y respuestas de células T CD4+ y CD8+ después de dos inyecciones parentales repetidas, con 21 días de intervalo entre ellas. Simultáneamente, este laboratorio desarrolló la versión BNT162b2, cuyo ARNm, contiene la conformación de prefusión del gen S de longitud completa, el cual, en teoría es más inmunogénico. Los resultados del estudio fase 3 de esta vacuna se reportaron en diciembre de 2020. (4)(2)(6)(5)(7)
Siguiendo con la línea de vacunas de ARNm, otro tipo de vacuna es la mRNA-1273, elaborada por Moderna, un laboratorio que tuvo experiencias previas en el desarrollo de vacunas contra el virus del MERS. También consiste en ARNm encapsulado en nanopartículas lipídicas, que codifica para proteína S estabilizada en su conformación previa a la fusión. Esta vacuna también mostró fuerte reacción de anticuerpos con dos inoculaciones, y respuesta principal del sistema inmune en células T CD4+ y Th1. Esta vacuna demostró una eficacia alrededor del 94.1% y efectos secundarios transitorios sin gravedad. (4)(2)(8)
En China, la Academia Militar de Ciencias Médicas, produce una vacuna ARNm llamada ARCoV, usando la proteína S-RBD como antígeno. En modelos animales se presentó rápida inmunización, induciendo producción de IgG, e incremento de linfocitos Th1. Una característica especial de esta vacuna es que no necesita un protocolo de refrigeración y transporte tan complicado como otras de su tipo. (2)(4)(6)(5)
Las vacunas de ADN consisten en la liberación de genes o fragmentos, que codifican para antígenos inmunogénicos, a través del uso de plásmidos como vector; este proceso, induce una respuesta inmunitaria celular y humoral eficaz. Para el desarrollo de una vacuna de este tipo, se requiere que el material genético seleccionado entre al núcleo, y se active el promotor mamífero presente en la estructura del vector. Esto desencadena la transcripción del gen utilizado en la vacuna, gracias a la maquinaria celular del huésped. Una vez terminado este proceso, las células presentadoras de antígeno, son las células diana que reciben el material genético. Lo anterior, gracias a la clonación de un casette de expresión de proteínas eucariotas, con un promotor fuerte en un plásmido bacteriano, que tiene la capacidad de propagarse en organismos como Escherichia coli, para la producción en masa. Hasta el momento, se han realizado ensayos en modelos animales, como el prototipo de vacuna manufacturado por Inovio Pharmaceuticals, con la vacuna INO-4800, que ha generado fuerte respuesta de células T y B. Otro ejemplo, es la vacuna bacTRL-Spike, que utiliza plásmidos de Bifidobacterium. Las fases III más adelantadas se han reportado en Enero 2021. (4)(6)(9)(10)(11)
Vacunas de vector viral
En este caso, el vector es viral, los vectores de adenovirus se cultivan fácilmente hasta obtener títulos altos en líneas celulares. Como los virus basan su replicación en una alta eficiencia de transducción, tienen una notable expresión transgénica, y poseen una gama elevada de tropismo celular. Una representante de este tipo es la vacuna Ad5-nCoV, que usa como vector el adenovirus tipo 5 (Ad5), desarrollada por CanSino Biological Inc. y Beijing Institute of Biotechnology, que utiliza también la proteína spike (S) optimizada de longitud completa como inmunógeno. Desencadenando así respuesta inmune celular y humoral. En algunas poblaciones, debido a la alta propagación de adenovirus, la presencia de anticuerpos preexistentes puede disminuir la eficacia de las vacunas basadas en este patógeno. La vacuna hAd5, fabricada por Immunity Bio, se ha reportado, tiene el potencial de dar mayor protección a pacientes con anticuerpos anti-adenovirus preexistentes. Esta vacuna usa una proteína S optimizada, y una proteína N conservada como antígenos. (3)(4)
Como alternativa de desarrollo de vacunas de vector viral, se encuentran en estudio fase III, aquellas derivadas de vectores Ad26 (vacuna Ad26.COV2-Sy), Ad35, así como vectores de Ad no humanos que tienen una seroprevalencia baja en las personas, como es el caso de Ad de chimpancé (chAd), como la vacuna ChAdOx1-nCoV-19 o (AZD1222), lograda por la universidad de Oxford y AstraZeneca, que expresa genes que codifican un codón para proteína S optimizada del coronavirus, insertado en una mutación del gen ChAdOx1 de replicación defectuosa de Chad. Los ensayos clínicos han revelado una óptica eficacia en países como Reino Unido y Brasil. El anticuerpo neutralizante ha mostrado alta eficacia, y también inducción de respuesta de células T. (2)(3)(4)(12)
Otro ejemplo, es la vacuna del Instituto de investigación ruso Gamaleya. Su vacuna Sputnik-V, fue controversial en su momento por el acelerado proceso de desarrollo que tuvo. Es una vacuna recombinante Ad25 y Ad26, usando como antígeno, la proteína S de longitud completa. Los estudios en general identifican esta vacuna como segura. (4)
Vacunas de proteínas recombinantes
Sabiendo que una proteína recombinante, son aquellas que se producen al expresar un gen producto de la clonación, en una especie o célula distinta de la original, Novavax y su vacuna NVX-CoV2373, fue la primera en desarrollarse con este fin. La vacuna consiste en la expresión y purificación en insectos, de una proteína S trimérica recombinante de longitud completa. La vacuna ha mostrado alto grado de seguridad, y activación de respuesta de células Th1 CD4 T, con pocos efectos adversos. (4)(13)(14)
Otra representante de su linaje es la vacuna EpiVacCorona, generada por FBRI SRC VB VECTOR de origen ruso, que usa un péptido sintetizado químicamente de proteína SARS-CoV-2, como antígeno, conjugado con una proteína transportadora con un coadyuvante de aluminio. La fase III está en desarrollo. (4)
Vacunas inactivadas
Son un método tradicional de producción de vacunas, que se purifican a partir de células infectadas por virus. Lo importante, es la selección de las cepas de virus adecuadas. Para SARS-CoV-2, existe la vacuna CoronaVac, desarrollada por Sinovac Biotech, es una vacuna cuyo objetivo son las cepas del SARS-CoV-2 que circulan en diferentes regiones del mundo. La semilla viral se cultivó en células Vero (linaje obtenido a partir de células epiteliales de tejido nefrológico de mono verde africano), e inactivadas con β-propil lactona. Los resultados en modelos animales mostraron un amplio espectro de neutralización y respuesta inmune contra 10 diferentes cepas del SARS-CoV-2. La fase 3 de esta vacuna, se ha probado en Brasil, Indonesia, y Turquía. Otros ejemplos de este tipo de vacunas son: New Crown COVID-19, desarrollada por Wuhan Institute of Biological Products, y BBIBO-CorV, desarrollada por Beijing Institute of Biological Products y Sinopharm. (4)(3
Vacunas vivas atenuadas
La Universidad Nacional de Chungnam publicó el primer estudio, donde se desarrolló una vacuna atenuada o de virus atenuado contra el SARS-CoV-2. Se generó una cepa adaptada al frío que no provocó afecciones corporales serias en modelos murinos tipo K18-ACE2. Seis días de la inoculación del virus atenuado, se encontraron signos de patología pulmonar leve en los animales estudiados. También se observó la presencia de títulos elevados de anticuerpos neutralizantes, así como respuesta inmunitaria celular y de anticuerpos IgA en mucosa. Esta vacuna se aplicaría en una sola dosis de inoculación intranasal. El estudio en humanos evoluciona prometedor. Otras investigaciones en curso revelan el posible desarrollo de vacunas de virus atenuado, aprovechando deleciones, adaptaciones o variantes del SARS-CoV-2. (4)
Conclusión
El presente artículo mostró las principales plataformas de desarrollo de vacunas contra el SARS-CoV-2, para contrarrestar la COVID-19. Aún existen estudios en progreso. Las plataformas siguen abiertas a estudio; porque la pandemia sigue vigente, y los laboratorios mantienen el esfuerzo en la creación de estrategias para el control de la pandemia.
Referencias
- Hodgson SH, Mansatta K, Mallett G, Harris V, Emary KRW, Pollard AJ. What defines an efficacious COVID-19 vaccine? A review of the challenges assessing the clinical efficacy of vaccines against SARS-CoV-2. Lancet Infect Dis [Internet]. 2021;21(2):e26–35. Available from: http://dx.doi.org/10.1016/S1473-3099(20)30773-8
- Jeyanathan M, Afkhami S, Smaill F, Miller MS, Lichty BD, Xing Z. Immunological considerations for COVID-19 vaccine strategies. Nat Rev Immunol [Internet]. 2020;20(10):615–32. Available from: http://dx.doi.org/10.1038/s41577-020-00434-6
- Ura T, Yamashita A, Mizuki N, Okuda K, Shimada M. New vaccine production platforms used in developing SARS-CoV-2 vaccine candidates. Vaccine. 2021;39(January):197–201.
- Li DD, Li QH. SARS-CoV-2: vaccines in the pandemic era. Mil Med Res. 2021;8(1):1–15.
- Soo K, Sun X, Aikins ME, Moon JJ. Non-viral COVID-19 vaccine delivery systems Kyung. Adv Drug Deliv Rev. 2021;169(January):137–51.
- Dong Y, Dai T, Wei Y, Zhang L, Zheng M, Zhou F. A systematic review of SARS-CoV-2 vaccine candidates. Signal Transduct Target Ther [Internet]. 2020;5(1). Available from: http://dx.doi.org/10.1038/s41392-020-00352-y
- Haynes BF. A New Vaccine to Battle Covid-19. N Engl J Med. 2020;1–2.
- Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2020;1–14.
- Moura M, Marçal G, Garcia S, Mendonça M. DNA vaccines against COVID-19: Perspectives and challenges. Life Sci Sp Res. 2021;267(January):2–8.
- Saborni Chakraborty, Vamsee Mallajosyula, Cristina M. Tato, Gene S. Tan, Taia T. Wang. SARS-CoV-2 vaccines in advanced clinical trials: Where do we stand? Adv Drug Deliv Rev. 2021;(January):2–79.
- Awadasseid A, Wu Y, Tanaka Y, Zhang W. Current advances in the development of sars-cov-2 vaccines. Int J Biol Sci. 2020;17(1):8–19.
- Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2021;397(10269):99–111.
- Keech C, Albert G, Cho I, Robertson A, Reed P, Neal S, et al. Phase 1–2 Trial of a SARS-CoV-2 Recombinant Spike Protein Nanoparticle Vaccine. N Engl J Med. 2020;383(24):2320–32.
- Simran Preet Kaur, Vandana Gupta *. COVID-19 Vaccine: A comprehensive status report. Virus Res. 2020;288(January).